
炎症性肠病(Inflammatoryboweldisease,IBD)是一种病因未明的肠道非特异性炎症性疾病,包括克罗恩病(Crohn’sdisease,CD)和溃疡性结肠炎(Ulcerativecolitis,UC)。CD病变主要累及末端结肠及临近结肠,UC病变多累计直肠及部分结肠。据中国疾病预防控制中心统计数据显示,预计2025年我国IBD患者数量将增至150万例。IBD为慢性复发性疾病,患者常需终生用药,以控制临床症状、缓解黏膜屏障破坏等病理损伤及减少复发。IBD的药物治疗效果常受到患者依从性、经济状况等的影响,且糖皮质激素等药物的应用常伴随诸多副作用。
炎症性肠病患者常伴随肠道病理改变,特征为肠道炎症及肠黏膜屏障的损伤等。现有研究结果显示,肠黏膜屏障损伤的主要致病机制是肠道上皮细胞的分化异常。肠上皮细胞分化的关键基因在肠道疾病的发病机制中可被异常的细胞信号通路所破坏。Notch1信号通路是介导结肠上皮细胞的分化过程的重要通路之一。Hes-1靶基因被激活之后,Notch-1信号继续传导,可发挥其相应作用:诱导肠道祖/干细胞增殖,调控结肠上皮细胞的分化等。结肠上皮细胞可进而再生,修复上皮细胞的损伤,缓解肠道黏膜屏障的破坏。现有研究结果表明炎症性肠病的易感性增加,可能与Notch1信号的异常缺乏有关。
由于现阶段IBD药物效果有限,且常伴有副作用,而IBD病情常迁延不愈,易复发,患者生活质量常受到严重影响。研究者们一直尝试寻找具有治疗IBD作用的新型药物或膳食补充剂,而食源性天然产物中多糖类物质的活性作用受到了广泛关注。
岩藻多糖(Fucoidan,FUC)是一组硫酸盐碳水化合物,主要来源于海洋褐藻,由于其药用特性及来源广泛,长期以来被用为膳食补充剂,抗炎作用已得到广泛认可。体外研究结果显示岩藻多糖可缓解由LPS诱导的小胶质细胞炎症反应,还可抑制牙龈组织炎症、促炎因子的表达及中性粒细胞的聚集等。国外一项研究结果表明,低分子量的岩藻多糖可以促进新霉素损伤的斑马鱼毛细胞的再生,而其作用机制可能与Notch信号通路有关。已有多个动物体内实验显示,岩藻多糖可明显缓解模型组动物的IBD相关症状,改善评分,减轻黏膜屏障的损伤。但由于其结构复杂多样,来源广泛,其抗炎作用机制尚不完全明确。
脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁外膜中的一种特有成分,有促炎等作用。青岛大学附属医院研究人员使用LPS干预人正常结肠上皮细胞,构建炎症损伤模型。基于Notch1信号通路,探讨了青岛明月海琳岩藻多糖生物科技有限公司生产的褐藻浓缩粉(岩藻多糖含量≥90%)对LPS诱导的人正常结肠上皮细胞(NCM460)炎症损伤的影响,为岩藻多糖未来应用于改善IBD患者症状及病理损伤提供研究基础。
研究人员利用对体外培养NCM460细胞株,将细胞分为(1)空白组:仅添加完全培养基,不含细胞;(2)对照组:使用完全培养基培养细胞;(3)LPS诱导组:在体外培养的细胞中加入脂多糖(LPS,1mg/L)进行干预,构建炎性损伤的细胞模型;(4)LPS+低、中、高剂量岩藻多糖组:采用LPS干预细胞构建细胞炎症损伤模型后,分别用低、中、高(50、100、200μg/L)浓度岩藻多糖完全培养基孵育细胞。观察岩藻多糖对炎症损伤细胞的影响。
研究结果:
1岩藻多糖(FUC)对人正常结肠上皮细胞增殖的影响。
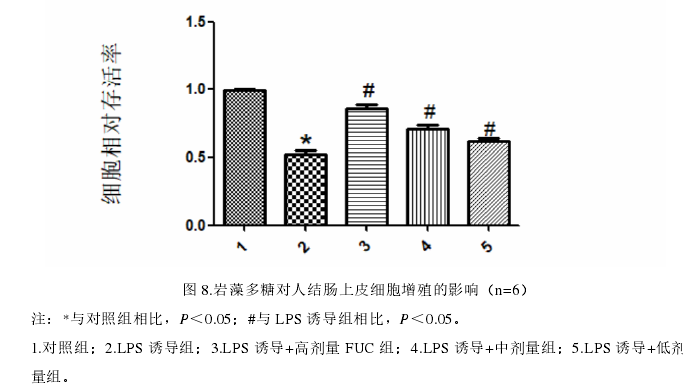
CCK-8实验结果显示在FUC处理24小时后,与LPS诱导组相比,其细胞存活率显著上升(P<0.05,见图8),且随着FUC浓度的增加,细胞存活率也随之上升。表明岩藻多糖可显著缓解由炎症损伤所造成的细胞增殖率降低,且呈剂量依赖性。
2岩藻多糖(FUC)对人正常结肠上皮细胞炎症因子表达的影响。
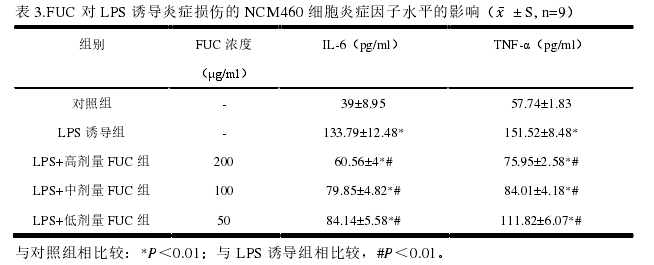
Elisa检测实验结果显示,经岩藻多糖孵育后,与LPS诱导组相比,细胞培养液中炎症因子IL-6及TNF-α的水平显著降低(P<0.05,见表3),且呈浓度依赖性。
3岩藻多糖(FUC)对LPS诱导炎症损伤的NCM460细胞IL-6、TNF-α等基因mRNA表达量的影响。
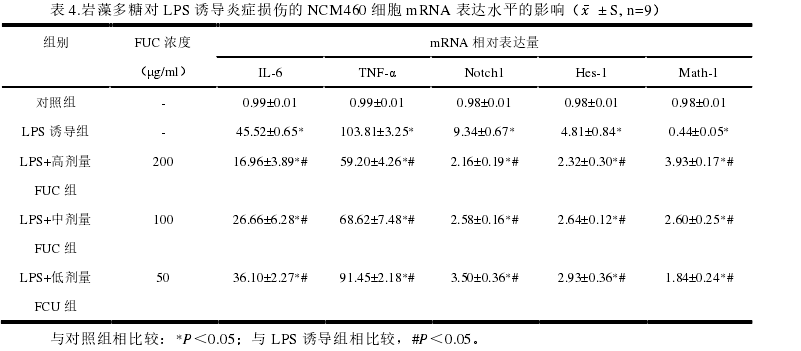
通过实时荧光定量PCR实验观察到,LPS诱导组中IL-6、TNF-α、Notch1及Hes-1的表达量显著升高(P<0.01,表4),经FUC处理后表达量与LPS诱导组相比显著降低(P<0.01,表4)。其中IL-6、TNF-α为促炎因子,其表达量下降表明FUC可显著缓解细胞的炎症损伤。LPS诱导组中Math-1的表达量与对照组相比显著降低,经FUC处理后的细胞Math-1表达量与LPS诱导组相比显著升高(P<0.01,表4)。表明FUC可能通过Notch-1信号通路,间接调控了Hes/Math1轴,使分泌细胞的分化异常得到缓解,同时改善肠粘膜屏障的损伤。
研究结果表明,FUC可有效缓解LPS所造成的肠道炎症损伤。其机制可能与炎症因子表达水平的降低有关,Notch-1信号通路可能在其中起重要作用。
综上所述,岩藻多糖应用于炎症性肠病患者具有辅助治疗作用,对肠道屏障的炎症损伤具有改善作用,同时可缓解炎症性肠病的临床症状。
参考文献:
1 N. Khan, A. M. Abbas, L. A. Bazzano, Y. N. Koleva, M. Krousel-Wood. Long-term oral mesalazine adherence and the risk of disease flare in ulcerative colitis: nationwide 10-year retrospective cohort from the veterans affairs healthcare system. Alimentary pharmacology & therapeutics. 2012;36(8):755-764.
2 Yiwei Wang, Dan Huang, Kai-Yuan Chen, et al. Fucosylation Deficiency in Mice Leads to Colitis and Adenocarcinoma. Gastroenterology. 2017;152(1):193-205.e110.
3 S. Tocaciu, L. J. Oliver, R. M. Lowenthal, et al. The Effect of Undaria pinnatifida Fucoidan on the Pharmacokinetics of Letrozole and Tamoxifen in Patients With Breast Cancer. Integrative cancer therapies. 2018;17(1):99-105.
4 J. Park, J. D. Cha, K. M. Choi, K. Y. Lee, K. M. Han, Y. S. Jang. Fucoidan inhibits LPS-induced inflammation in vitro and during the acute response in vivo. International immunopharmacology. 2017;43:91-98.
5吴俊仙, 董昀凡, 袁 涛, 等. 岩藻多糖对炎症性肠病的作用及其机制. 南京医科大学学报. 2019(9):1304-1308.
6 C. J. O'Shea, J. V. O'Doherty, J. J. Callanan, D. Doyle, K. Thornton, T. Sweeney. The effect of
algal polysaccharides laminarin and fucoidan on colonic pathology, cytokine gene expression
and Enterobacteriaceae in a dextran sodium sulfate-challenged porcine model. Journal of
nutritional science. 2016;5:e15.
7林媛. 基于Notch信号探讨岩藻多糖对人结肠上皮细胞炎症损伤的保护作用[D].青岛:青岛大学,2020.
原创文章,未经授权,禁止转载。
更多健康资讯,请关注“BMSFu™岩藻多糖”。

鲁公网安备 37021102001208号
Copyright ©2019 明月海藻生物健康科技集团 版权所有